JCTLM
JCTLMの活動
JCTM (Joint Committee On Traceability in Laboratory Medicine:臨床検査医学におけるトレーサビリティ合同委員会)は臨床化学分野でのトレーサビリティの確保、比較同等性を担保することを目的に2002年6月のBIPM(国際度量衡局)と国際臨床化学連合(IFCC)の呼びかけにより、標準分野を代表してBIPMや各国標準研究所、臨床検査分野からはIFCCおよび各国の政府系機関、臨床検査関連機関、WHO、臨床検査試薬および機器製造メーカ、さらに試験所の測定能力を規格化する機関として試験所認定機関(ILAC)等が参加しJCTLMが設立された。
日本からは、産業技術総合研究所計測標準研究部門(AIST/NMIJ)、日本臨床検査標準協議会(JCCLS)、日本臨床検査薬協会(JACRI)が正式メンバーとしてJCTLMに参加している。JCTLMでの活動は、JCCLS内に設置された標準物質委員会 において日本国内の臨床検査関連の各機関に発信し、同時に標準物質委員会で国内意見の調整と集約を行って、JCTLMに提案している。JCTLMは、直接的には2003年12月からヨーロッパで施行された「欧州におけるIVD(体外診断検査)に関するEU指令」に対応して、臨床検査分野における国際整合性のとれた測定法や標準物質を定義することを目指している。
IVDに関するEU指令は、欧州で販売されるすべての臨床検査薬および臨床検査機器に、それらのトレーサビリティを宣言することを求めている。すなわち、臨床検査試薬および臨床検査機器等メーカは、自らの測定結果あるいは製品のトレーサビリティを自らで証明するか、あるいは上位標準(標準物質あるいは標準測定法)に対してトレーサブルであることを示す必要がある。
JCTLMは中長期的には以下のように、臨床化学分野全般における基盤整備を行うことを目標に活動を行っている。
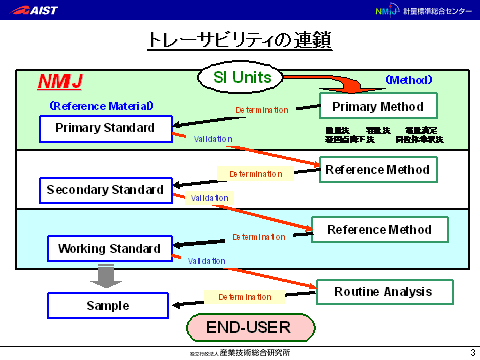
- 臨床検査で最も完成されたトレーサビリティの例(図1)
- 国立標準研究所と臨床検査研究所との連係強化
- 臨床検査トレーサビリティの概念の啓発
- 臨床検査における認証標準物質・計測方法等の開発
- 測定システムや測定試薬を開発するIVD企業の育成
図1.臨床化学で最も完成されたトレーサビリティの例